Автор: Сотников Владимир Валерьевич, к.в.н., главный врач Ветеринарной клиники неврологии, травматологии и интенсивной терапии, г. Санкт-Петербург.
Предисловие
Состояние диагностики заболеваний нервной системы в ветеринарии находится на крайне низком уровне в России. Диагнозы, как правило, не ставятся, а придумываются ветеринарными врачами. Инсульт – одно из заболеваний, которое часто (85% всех придуманных диагнозов) ошибочно диагностируется у животных с неврологическим проблемами по аналогии с медициной. Проблема даже не в том, что подобное заболевание, которое обозначается у людей термином «инсульт», не может быть у животных в силу их физиологических особенностей, а в том, что ветеринарные деятели, назначая препараты для лечения инсульта у собак, понятия не имеют, чем профилактируют данное заболевание у людей. В результате назначенное лечение не имеет никакого отношения к лечению инсультов ни у людей, ни у собак тем более. Анализ 450 случаев лечения собак с неврологическими расстройствами, связанными с симптомами поражения головного мозга, выявил следующую закономерность: у всех пациентов поставленный диагноз не соответствовал реальности.
Ни у одного из этих пациентов не был применен алгоритм диагностики заболеваний головного мозга, принятый и используемый неврологами во всем мире.
Мозг головной (передний мозг, ствол мозга, мозжечок) исследуется следующим образом:
- Полный анализ крови, биохимия крови, анализ мочи.
- Электродиагностика (электроэнцефалография, аудиометрия).
- Магнитно-резонансное исследование.
- Исследование спинномозговой жидкости.
Часто проводится неполное исследование крови, и на основании неполных данных врачами придумывается диагноз. Нередко путают компьютерную томографию и МРТ. Зачастую диагноз пытаются определить только на основании ЭЭГ без МРТ и без исследования ликвора. Неправильная и неполная диагностика, отсутствие знаний и профессионализма и порождает такие «экзотические» диагнозы, как «культит»- воспаление культи матки у животного с менингиомой; увеличение селезенки (какой точный диагноз!) у собаки с новообразованием гипофиза. В результате собаку напрасно прооперировали, из-за врачебной ошибки она лишилась селезенки. У лабрадора с олигодендроглиомой был разрезан желудок, т.к. горе-врач предположил отравление мышьяком.
Часты случаи путаницы неврологических и ортопедических пациентов.
Избежать этих ошибок, поставить точный диагноз и провести адекватное лечение можно выполнив в полном объеме диагностический алгоритм; ставить реально существующие диагнозы; выбирать методы лечения и препараты согласно имеющимся рекомендациям, описанным в руководствах по лечению заболеваний животных, а также принятым и опубликованным Всемирной ассоциацией ветеринарных врачей.
Назначение препаратов, таких как травматин, солкосерил, церебролизин, кокарбоксилаза, пирацетам, блокады новокаиновые, эссенциале, сульфокамфокаин, артрогликан, кокарбоксилаза, рибоксин, цистон, кавинтон, пищевые добавки, может стать поводом для сомнений в том, что лечащий врач правильно определил диагноз, понимает, от чего он собирается лечить своего пациента, и способен оказать квалифицированную помощь.
Таблица. Распределение в процентном соотношении встречаемости заболеваний головного мозга у собак.

| Дегенеративные (дегенеративное заболевание нервной ткани, и др.) | 5 |
Как видно из выше приведенной таблицы, сосудистые заболевания у собак являются весьма редкими. На первом месте — воспаления различной этиологии, в том числе связанные со средним отитом (часто без изменений в наружном слуховом проходе). Воспалениям подвержены собаки карликовых пород. Аномалии развития встречаются часто у собак карликовых пород и иногда у собак крупных пород.
Несмотря на то, что сосудистые нарушения редки у собак, статья, приведенная ниже, поможет пролить свет на эту проблему и дать общее представление о состоянии этого вопроса на сегодняшний день.
Острые нарушения мозгового кровообращения у собак: почему они происходят, что исследовать и как лечить
LUIS GAITERO, DVM, ECVNA
Острое нарушение мозгового кровообращения (ОНМК) определяется как внезапная непрогрессирующая очаговая дисфункция головного мозга в результате цереброваскулярного заболевания (ЦВЗ). Причиной таких расстройств может стать инфаркт или кровоизлияние. Считается, что у собак ЦВЗ распространены меньше, чем у людей. Однако с появлением в ветеринарии современных методов визуальной диагностики, в частности, магнитно-резонансной томографии (МРТ), эти нарушения стали распознаваться чаще и уже не считаются редкими. В некоторых специализированных ветеринарных учреждениях ЦВЗ составляют примерно 1,5 — 2% случаев неврологических нарушений. В этой статье представлен обзор ЦВЗ у собак с упором на патологическую физиологию, этиологию, клинические признаки и диагностику, а также существующие методы лечения и прогноз восстановления.
Термином «цереброваскулярное заболевание» (ЦВЗ) обозначают любые нарушения функции головного мозга, обусловленные патологическими процессами в кровеносных сосудах. К ним относятся закупорка просвета эмболом или тромбом, разрыв сосуда, изменение проницаемости стенки и повышение вязкости крови, а также прочие изменения качества кровотока в сосудах мозга. Острое нарушение мозгового кровообращения (ОНМК) является третьей по распространенности причиной смерти у людей, после рака и заболеваний сердца. Это самое частое неврологическое нарушение у взрослых, встречающееся при 50% неврологических заболеваний, при этом 77% случаев относятся к ишемическим, а 23% — к геморрагическим. Гипертензия, заболевания сердца, фибрилляция предсердий, сахарный диабет (СД), курение и гиперлипидемия – известные факторы риска.
Если клинические признаки очагового поражения исчезают в течение 24 часов, эпизод называют преходящим приступом ишемии (ППИ). Такие явления указывают на временную очаговую ишемию, однако точный механизм пока недостаточно понят. ППИ, длящиеся от нескольких минут до 1 часа, часто становятся предупреждающими сигналами грозящей окклюзии сосуда, особенно внутренней сонной артерии. У собак полное удаление сонной артерии не вызывает неврологических растройств и часто применяется для уменьшения кровотечения из носовой полости при ринотомии. Однако длительные ППИ часто бывают вызваны эмболом, не оставляющим длительного эффекта.1 Подозревают, что ППИ встречаются у животных, однако редко распознаются.
Общей ишемией называют диффузное ишемическое явление, в отличие от очагового. При этом поражается весь головной мозг, и это состояние часто бывает связано с остановкой сердца и дыхания или осложнениями при наркозе (например, тяжелой гипотензией и гипоксией). Возможно, что брахицефалические породы собак и кошек предрасположены к ишемии, особенно при применении кетамина для индукции и поддержания наркоза.
Кровоснабжение головного мозга
Кровь поступает к мозгу по пяти парам крупных артерий: ростральной, средней и каудальной мозговым артериям, а также ростральной и каудальной мозжечковым артериям (рис. 1).
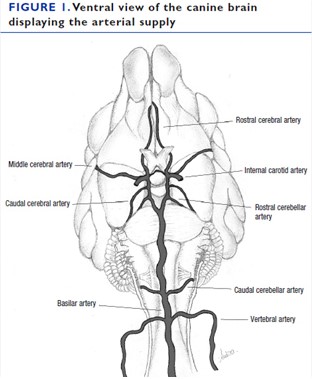
Слева:
Средняя мозговая артерия
Каудальная мозговая артерия
Базилярная артерия
Справа:
Ростральная мозговая артерия
Внутренняя сонная артерия
Ростральная мозжечковая артерия
Каудальная мозжечковая артерия
Позвоночная артерия
Мозговые и ростральная мозжечковая артерия берут начало из артериального круга головного мозга (Виллизиева круга), расположенного у основания мозга и образованного внутренними сонными и базилярными артериями, в то время как каудальные мозжечковые артерии берут начало из базилярной артерии. Зоны кровоснабжения крупными артериями показаны в таблице 1. Более мелкие ветви, берущие начало от Виллизиева круга и пяти пар главных артерий, пронизывают паренхиму в виде глубоких и поверхностных прободающих артерий. К ним относятся проксимальная и дистальная прободающие артерии таламуса, снабжающие последний кровью, артерии полосатого тела, несущие кровь к базальным ядрам и таламусу, а также каудальные прободающие артерии и парамедиальные ветви, несущие кровь к каудальной части таламуса, среднему мозгу и мосту.
Таблица 1. Кровоснабжение головного мозга собак: главные артерии
Патологическая физиология ишемических ОНМК
Потребность головного мозга в кровоснабжении исключительно высока; он зависим от адекватного поступления крови больше, чем любой другой орган. Хотя мозг составляет всего 2% от массы тела, он забирает 20% выбрасываемой сердцем крови и 15% кислорода.1 Существует несколько механизмов, обеспечивающих достаточное кровоснабжение мозга, включая саморегуляцию в зависимости от давления и химического состава и анастомозы кровеносных сосудов.13
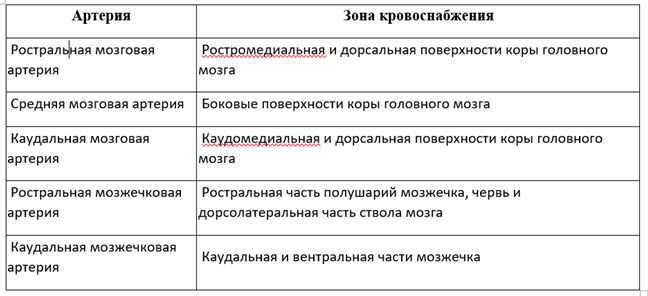
Недостаточный приток крови вызывает ишемию, в конечном итоге приводящую к ишемическому некрозу или инфаркту из-за гибели нервной ткани (Рис. 2).
Ишемия запускает сложный многофакторный каскад биохимических и сосудистых реакций с преобладанием вторичных повреждений, что в конечном итоге приводит к прогрессивному поражению ткани мозга и дальнейшему ухудшению состояния. Данная серия явлений включает истощение запасов аденозинтрифосфата (АТФ), избыточное высвобождение возбуждающих нейромедиаторов (глутамата, аспартата), нарушение саморегуляции мозгового кровотока, накопление кальция и натрия в клетках, образование реакционноспособных соединений кислорода (свободных радикалов) и последующую воспалительную реакцию.8,14 Повреждение под действием свободных радикалов играет главную роль в механизме вторичной травмы.
Очаговое ишемическое повреждение может возникнуть в результате тромбоза, обусловленного процессом, или обструкции материалом, образовавшимся в отдаленных сосудах (эмболия).
В зоне инфаркта различают центральную часть с тяжелой ишемией и необратимым повреждением тканей. Ее можно дифференцировать от периферических зон ишемии, где уменьшение притока крови менее выражено. Ткань в периферической зоне ишемии еще может восстановиться, на что и направлена терапия.14 При возобновлении притока крови к ишемической зоне или нарушении венозного оттока возможно скопление крови, приводящее к тому, что мы называем геморрагическим или «красным» инфарктом, в противоположность негеморрагическому или «белому» инфаркту.
Геморрагические ОНМК
У собак спонтанные геморрагические ОНМК встречаются реже ишемических ОНМК.
Во время геморрагического инфаркта в ткани головного мозга скапливается излившаяся из сосудов кровь, образуя гематому, сдавливающую окружающие ткани. В первые 6 часов после кровоизлияния происходит расширение сгустка, а в течение нескольких дней развивается отек вокруг пораженной области. По существу, при тяжелых кровоизлияниях образуется очаг, занимающий объем, что приводит к повышению внутричерепного давления и уменьшению мозгового кровотока с риском сдавливания окружающих тканей, сдвига средней линии и обструктивной гидроцефалии.
Классификация и этиология
Ишемические ОНМК можно классифицировать по следующим факторам:
- Зона кровоснабжения: ростральной мозговой, средней мозговой, каудальной мозговой, ростральной мозжечковой, каудальной мозжечковой, прободающей, базилярной или позвоночной артериями
- Размер: территориальный (в результате поражения одной из крупных артерий) или лакунарный (в результате поражения более мелких артерий, например, прободающих ветвей)
- Возраст: свежий или организованный
- Наличие вторичного кровоизлияния: негеморрагический/ белый, или геморрагический/ красный
- Патология: артериальный или венозный
- Механизм: тромб, эмбол, нарушение гемодинамики
- Первопричина: состояние гиперкоагуляции, гипертензия, атеросклероз, эмболия (жировая, воздушная, паразитами, клетками опухоли) или идиопатический.
Ишемические инфаркты могут иметь различную этиологию, включая атеросклероз у собак с гипотериозом, хронические заболевания почек (особенно нефропатию с потерей белка), гиперадренокортицизм, СД, гипертензию, эмболию (в результате сепсиса, бактериального эндокардита, новообразований, кардиомиопатии, заражения сердечными гельминтами, фиброзно-хрящевой, жировой или воздушной эмболии), внутрисосудистой лимфомы, состояния гиперкоагуляции (гиперадренокортицизм, нефропатия с потерей белка и новообразования), повышение вязкости крови, васкулит или распространение инфекции/воспаления центральной нервной системы. Тем не менее у людей 40% ишемических инсультов классифицируются как криптогенные, то есть выяснить причину не удается.1,4 В отличие от людей, у собак атеросклероз редко приводит к инфарктам, а последние, если происходят, часто связаны с гипотиреоидизмом или СД.4
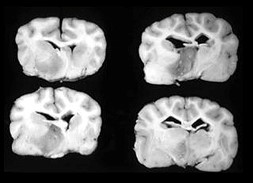
Инфаркты могут быть вторичными в результате ЦВЗ, обусловленных поражением мелких сосудов (поверхностных или глубоких прободающих артерий). Это может привести к мелким инфарктам, так называемым лакунарным, или поражению крупных сосудов (главных артерий), способному привести к более крупным «территориальным» инфарктам (рис. 3).
А. Т1-взвешенное изображение, сагиттальная проекция. Территориальный инфаркт в зоне кровоснабжения ростральной мозжечковой артерией.
В. Изображение, полученное в режиме инверсии-восстановления с ослаблением сигнала от жидкости (FLAIR), поперечная проекция. Лакунарный инфаркт в левой части таламуса.
С. Т2-взвешенное изображение, поперечная проекция. Территориальный инфаркт в зоне кровоснабжения правой средней мозговой артерией.
D. Т2-взвешенное изображение, поперечная проекция. Лакунарный инфаркт в правой части таламуса.
В два связанных ретроспективных исследования было включено 33 и 40 собак с подозрением на инфаркт мозга; 60% инфарктов были территориальными, а 40% — лакунарными, поражающими преимущественно зону кровоснабжения ростральной мозжечковой артерией. Все инфаркты были негеморрагическими.16,17 Количество спаниелей и грейхаундов было выше, чем собак других пород.
В третьем исследовании 11 из 14 поражений располагались в области, кровоснабжаемой ростральной мозжечковой артерией, а 6 из 12 собак были спаниелями или метисами спаниелей, что позволяет предположить породную предрасположенность.18 У мелких пород отмечена тенденция к большей частоте территориальных инфарктов мозжечка,18 в то время как крупные породы были более склонны к лакунарным инфарктам таламуса и среднего мозга. Примерно у 50% собак имелись основные метаболические нарушения, потенциально связанные с тромбоэмболическим нарушением, преимущественно хронические почечные заболевания и нелеченный гиперадренокортицизм. Более чем у 40% собак выявить основное заболевание не удалось (криптогенный инфаркт), что сходно с описанным процентом у людей.
Прочие сопутствующие нарушения включали СД, стеноз аорты, гемангиосаркому, диссеминированное внутрисосудистое свертывание и феохромоцитому. Гипертензия присутствовала в 28% случаев, однако во всех случаях была установлена причина.
Геморрагические ОНМК можно классифицировать на основании:
- Анатомической локализации: эпидуральные, субдуральные, субарахноидальные, интрапаренхиматозные и интравентрикулярные
- Размеру: мелкие или крупные
- Возрасту: сверхострые, острые, ранние подострые или хронические
- Этиологии.
Кровоизлияния в паренхиму мозга обусловлены преимущественно системной артериальной гипертензией или образуются вторично по самым различным причинам, включая новообразования в полости черепа (в частности, глиомы, опухоли надпочечника и гемантиосаркомы), геморрагический инфаркт, коагулопатии, заражение паразитами (аномальная миграция), васкулит (некротизирующий), пороки развития сосудов, церебральная амилоидная ангиопатия, а также могут быть идиопатическими (криптогенными, спонтанными). ОНМК характеризуется острым или сверхострым развитием очаговых, асимметричных и непрогрессирующих симптомов дисфункции мозга. Усиление отека может привести к дальнейшему ухудшению состояния в первые 72 часа.2 При кровоизлияниях в мозг течение может быть более прогрессирующим. Специфические неврологические нарушения зависят от локализации и размера зоны ОНМК. Например, парадоксальный вестибулярный синдром, при котором голова наклонена в сторону, противоположную поражению, часто наблюдается при инфарктах мозжечка у собак, в то время как судороги встречаются как нечастое осложнение ишемического инфаркта мозга.
У людей выявлена корреляция между клиническими признаками, результатами визуальной диагностики и локализацией инфаркта, механизмом инсульта (эмболический или тромботический) и возможными сопутствующими заболеваниями, однако у собак она пока неясна.1 Однако у собак известны 3 клинических синдрома, связанные с предположительными инфарктами таламуса:
- Парамедиальные поражения, приводящие главным образом к вестибулярной дисфункции
- Обширные поражения в дорсальной части, приводящие главным образом к вестибулярной атаксии, движению по кругу и нарушениям рефлекса угрозы с противоположной стороны
- Вентролатеральные поражения, приводящие главным образом к движению по кругу и проприоцептивным нарушениям с противоположной стороны.
Кроме того, лакунарные инфаркты, поражающие базальные ганглии в зоне кровоснабжения лентикулостриарной артерией (стриатокапсулярный инфаркт мозга) приводят к выпадению части поля зрения (дефекту поля зрения, затрагивающему либо 2 правые, либо 2 левые половины поля зрения обоих глаз), проприоцептивным нарушениям с противоположной стороны и гемипарезу, а также гипералгезии лицевой части.20
Диагноз
Для исключения других причин острых неврологических симптомов и подтверждения подозрения на ОНМК необходимо исследование головного мозга современными методами визуальной диагностики (КТ и МРТ). При подозрении на инсульт по результатам визуальной диагностики необходимо провести исследования для поиска лежащей в основе причины.
МРТ — значительно более чувствительный метод распознавания ишемического ОНМК, чем КТ, и позволяет выявить незначительные изменения или потерю сигнала в сверхострую фазу (первый день).4
Ишемический инфаркт соответствует зоне кровоснабжения определенными сосудами и четко отграничен от окружающей нормальной ткани. Он более выражен в сером веществе, а эффект сдавливания окружающих тканей отсутствует или минимален. При МРТ на Т1-взвешеннх изображениях обнаруживаются гипоинтенсивные зоны, в то время как на Т2-взвешенных изображениях и в режиме инверсии-восстановления с ослаблением сигнала от жидкости (FLAIR) ишемическая зона гиперинтенсивна, причем гиперинтенсивность усиливается в течение первых 24 часов (рис. 3). Усиление контраста отсутствует или незначительно, хотя может стать заметнее через 7 – 10 дней, особенно на периферии.
Существует несколько техник функциональной МРТ, подходящих для ранней диагностики ишемических инсультов, включая диффузионно-взвешенные изображения, карты кажущегося коэффициента диффузии, перфузионно-взвешенные изображения и МРТ-ангиография.3 Диффузионно-взвешенные изображения повышают чувствительность и специфичность диагностики сверхострых ишемических ОНМК, позволяя выявить гиперинтенсивный очаг через несколько минут после его возникновения.
С другой стороны, КТ – исключительно чувствительный метод диагностики острых кровоизлияний, с линейным взаимоотношением между ослаблением и гематокритом в месте кровоизлияния. КТ часто применяется для первичного исследования с целью исключения кровоизлияния у людей с подозрением на инсульт. Кровоизлияние выглядит как очаг с повышенной плотностью с тенденцией к снижению плотности до равной окружающим тканям в течение месяца, усиление контраста варьирует.
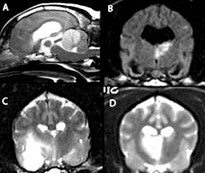
При диагностике сверхострых кровоизлияний в полость черепа метод МРТ равен КТ по достоверности и превосходит его при обнаружении незначительно выраженных микрокровоизлияний или основного патологического процесса в паренхиме, например, новообразования.21 На картину кровоизлияния при МРТ влияет несколько факторов (в частности, возраст гематомы) поскольку гемоглобин в последующем распадается на продукты с разными парамагнитными свойствами, а целостность мембран эритроцитов нарушается (рис. 4).
По МРТ-картине кровоизлияний в полость черепа выделяют пять фаз:
- Сверхострая
- Острая:1–3 суток; внутриклеточный дезоксигемоглобин, изо- или гипоинтенсивный на Т1-взвешенных изображениях, гипоинтенсивный на Т2-взвешенных.
- Ранняя подострая: 4–7 суток; внутриклеточный метгемоглобин с цельными эритроцитами, гиперинтенсивный на Т1-взвешенных изображениях, гипоинтенсивный на Т2-взвешенных.
- Поздняя подострая: 7–14 суток; внеклеточный метгемоглобин с лизисом эритроцитов, гиперинтенсивный на Т1- и Т2-взвешенных изображениях.
- Хроническая: 2 недель; ферритин и гемосидерин, изо- или гипоинтенсивный на Т1-взвешенных изображениях, гиперинтенсивный на Т2-взвешенных.
Т2-взвешенные изображения (в режиме градиентного эхо) позволяют наиболее точно выявить кровоизлияние, превосходя даже КТ, при низком сигнале или потере сигнала (рис. 4D).
Анализ спинномозговой жидкости помогает исключить другие дифференциальные диагнозы (например, энцефалит), однако имеет очень ограниченное значение для диагностики ОНМК, так как изменения обычно отсутствуют, либо присутствует легкий нейтрофильный или мононуклеарный плейоцитоз с повышенной концентрацией белка.16,17
Чтобы найти возможные основные причины ОНМК, необходимо провести минимальный набор исследований, включая полный клинический анализ крови, биохимический анализ крови и анализ мочи, а также рентген грудной клетки, УЗИ брюшной полости и несколько измерений артериального давления (АД). При подозрении на ишемический инфаркт в набор диагностических исследований необходимо включить определение соотношения белка и креатинина в моче, антитромбина III, D-димеров, эндокринные исследования, эхокардиографию и электрокардиографию. При подозрении на геморрагический инфаркт диагностические исследования должны включать измерение времени кровотечения из слизистой оболочки щеки, коагулограмму, анализ кала и посев крови и мочи.
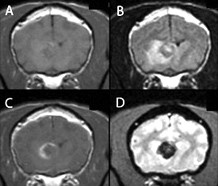
А. Т1-взвешенное изображение, поперечная проекция.
В. Т2-взвешенное изображение, поперечная проекция.
С. Т1-взвешенное изображение после введения контраста, поперечная проекция.
D. Т2-взвешенное изображение (градиентое эхо), поперечная проекция.
Лечение
Специфического лечения ишемических и большинства геморрагических ОНМК у собак не существует. Соответственно, терапевтический подход направлен на лечение лежащих в основе причин. Общие рекомендации включают поддерживающее лечение, контроль, коррекцию физиологических параметров (кислород, жидкость, АД и температура), лечение неврологических и других осложнений, уход (профилактика пролежней, аспирационной пневмонии и раздражения мочой), физиотерапию и энтеральное питание.
Поддержание системного АД в физиологическом диапазоне имеет решающее значение для сохранения перфузии головного мозга. Необходимо избегать гиповолемии или принять меры по ее устранению. Не следует лечить умеренную гипертензию, так как она помогает поддерживать перфузию головного мозга. Меры по снижению АД следует принимать только для пациентов с высоким риском конечной стадии повреждения органов (систолическое АД>180 мм рт. ст.).3 Терапевтическая гипотермия может снизить ишемическое повреждение нейронов, хотя она не рекомендуется до получения результатов дальнейшего обследования.23 Следует избегать гипергликемии.24
Ишемические ОНМК
Терапевтический подход состоит из двух компонентов: защиты нервной ткани и тромболитической терапии. Защита нервной ткани направлена на ослабление и сведение к минимуму вторичного повреждения.25,26 С целью улучшения исхода для пациента применяются методы лечения, направленные на механизмы вторичной травмы, включая образование реакционноспособных соединений кислорода. Ишемическое повреждение может усугубиться гипотензией и гипоксемией, поэтому абсолютно необходимо поддерживать системное АД и снабжение тканей кислородом.
Польза глюкокортикоидов не доказана и они могут повысить риск тяжелой инфекции, гипергликемии и осложнений со стороны желудочно-кишечного тракта.27
Прочие возможные нейропротективные средства, включая блокаторы кальциевых каналов и антагонисты рецептора глутамата (например, антагонисты рецептора N-метил-D-аспартата и α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) успешно позволяли уменьшить объем зоны инфаркта в экспериментальных исследованиях, однако их клиническая эффективность ограничена, неясна или требует оценки. Кроме того, блокаторы кальциевых каналов могут нежелательно влиять на сердечную мышцу и тонус сосудов.25,26,28
Восстановление мозгового кровотока путем тромболиза – приемлемый метод; однако данные о тромболитической терапии в медицине остаются противоречивыми, а в ветеринарии исследований для оценки ее эффективности не проводилось.
Профилактическая антиагрегатная терапия ацетилсалициловой кислотой в низкой дозе (0,5 мг/кг раз в 24 ч внутрь) может предотвратить формирование сгустка в зона сердечно-сосудистой системы, служащих доказанными источниками эмболов.29 Внутривенное введение тканевого активатора плазминогена (ТАП) людям одобрено в Канаде и представляется эффективнее введения стрептокиназы при применении в первые 3 часа после появления клинических симптомов. Однако это влечет риск внутричерепного кровоизлияния 6 – 21%.30,31 Хотя во время исследования, организованного Национальным институтом неврологических нарушений и инсультов (NINDS), у 50% пациентов удалось добиться полного восстановления с помощью ТАП,30 подгрупповой анализ показал, что у больных после тяжелого инсульта вероятность клинически значимого улучшения составляет всего 8%.32
Эндоваскулярная механическая тромболитическая терапия заключается во введении устройства для разрушения или извлечения сгустка, закупорившего мозговую артерию, через катетер во время ангиографии. Такие устройства позволяют удалить сгусток за несколько минут, в то время как растворение сгустка тромболитическими препаратами, даже вводимыми внутриартериально, занимает до 2 часов. Хотя такие механические устройства позволяют расширить терапевтический диапазон, удалить более крупные сгустки и снизить вероятность вторичных кровоизлияний, их окончательное влияние на исход неясно, а данных сравнения с внутриартериальным введением тромболитиков недостаточно. Данные устройства не одобрены министерством здравоохранения Канады.
Геморрагические ОНМК
Поддержание перфузии мозга за счет контроля гипотензии и повышения внутричерепного давления, а также лечение лежащих в основе нарушений – наиболее важные меры. Необходим тщательный контроль жизненных показателей и неврологического статуса в связи с риском неврологического ухудшения и нестабильности сердечно-сосудистой системы в первые 24 часа по причине расширения пораженного очага и сдавливания тканей. Основной первичной целью должна стать коррекция и контроль жизненных показателей (кислород, жидкость, системное АД и температура). Терапевтические вмешательства, направленные на стабилизацию структур полости черепа, должны проводиться после стабилизации общего состояния. Повышенное внутричерепное давление можно снизить, уменьшив сопутствующий отек мозга, оптимизировав объем крови в сосудах мозга (за счет контроля парциального давления диоксида углерода) и удаления материала, занимающего пространство в тканях. При повышенном внутричерепном давлении после кровоизлияния можно применять осмотические диуретики, маннит (0,5 – 1 г/кг внутривенно), так как случаи возможного усугубления внутричерепного кровоизлияния под действием этих препаратов неизвестны. При тяжелом состоянии и прогрессирующем ухудшении неврологического статуса можно рассмотреть возможность хирургического удаления операбельных крупных гематом, главным образом субарахноидальных, путем краниотомии.
Прогноз
Прогноз зависит от типа ОНМК, тяжести неврологических нарушений, наличия вторичных патологических явлений (отека, кровоизлияния и повышенного внутричерепного давления), исходного ответа на поддерживающее лечение и того, известна ли причина. Большинство собак с ишемическим ОНМК восстанавливается за несколько недель только на поддерживающей терапии. Однако наличие возможных основных заболеваний (например, нелеченного гиперадренокортицизма или хронической нефропатии) значительно уменьшает время выживания. Восстановление пациентов с прогрессирующим отеком в области пораженного очага, существующими повреждениями сосудов или непрерывным кровотечением происходит медленнее.33 Геморрагические ОНМК у собак встречаются гораздо реже ишемических ОНМК, однако связаны с большей смертностью.5,18,34
Литература:
- Ropper AH, Brown RH. Cerebrovascular disease. In: Adams and Victor’s Principles of Neurology, 8th ed. New York (NY: McGraw-Hill Professional; 2005:660-746.
- Platt SR, Garosi L. Canine cerebrovascular disease: do dogs have strokes? J Am Anim Hosp Assoc. 2003; 39(4):337-342.
- Garosi LS. Cerebrovascular disease in dogs and cats. Vet Clin Small Anim Pract. 2010; 40(5):65-79.
- Wessmann A, Chandler K, Garosi L. Ischaemic and haemorrhagic stroke in the dog. Vet J. 2009; 180(3):290-303.
- Sacco RL, Boden-Albala B, Gan R, et al. Stroke incidence among white, black, and Hispanic residents of an urban community: the Northern Manhattan Stroke Study. Am J Epidemiol. 1998; 147(3):259-268.
- Mortel KF, Meyer JS. Prospective study of vascular events and cerebral perfusional changes following transient ischemic attacks. Angiology. 1996; 47(3):215-224.
- Deitrich WD, Danton G, Hopkins AC, Prado R. Thromboembolic events predispose the brain to widespread cerebral infarction after delayed transient global ischemia in rats. Stroke. 1999; 30(4):855–862.
- Hillock SM, Dewey CW, Stefanacci JD, Fondacaro JV. Vascular encephalopathies in dogs: incidence, risk factors, pathophysiology, and clinical signs. Comp Cont Ed Pract Vet. 2006; 28(3):196-206.
- Bentley RT, March PA. Recurrent vestibular paroxysms associated with systemic hypertension in a dog. J Am Vet Med Assoc. 2011; 239(5):652-655.
- Timm K, Flegel T, Oechtering G. Sequential magnetic resonance imaging changes after suspected global brain ischaemia in a dog. J Small Anim Pract. 2008; 49(8):408-412.
- Panarello GL, Dewey CW, Barone G, Stefanacci JD. Magnetic resonance imaging of two suspected cases of global brain ischemia. J Vet Emerg Crit Care. 2004; 14(4):269-277.
- Evans HE. The heart and arteries. In: Evans HE, ed. Miller’s Anatomy of the Dog. Philadelphia (PA): WB Saunders Company; 1993:586–681.
- Bouma GJ, Muizelaar JP, Bandoh K, Marmarou A. Blood pressure and intracranial pressure-volume dynamics in severe head injury: relationship with cerebral blood flow. J Neurosurg. 1992; 77(1):15-19.
- Siesjö BK. Pathophysiology and treatment of focal cerebral ischemia. Part I. Pathophysiology. J Neurosurg. 1992; 77(2):169-184.
- Heiss WD, Graf R, Wienhard K, et al. Dynamic penumbra demonstrated by sequential multitracer PET after middle cerebral artery occlusion in cats. J Cereb Blood Flow Metab. 1994; 14(6):892-902.
- Garosi L, McConnell JF, Platt SR, et al. Clinical and topographic magnetic resonance characteristics of suspected brain infarction in 40 dogs. J Vet Intern Med. 2006; 20(2):311-321.
- Garosi L, McConnell JF, Platt SR, et al. Results of diagnostic investigations and long-term outcome of 33 dogs with brain infarction (2000-2004). J Vet Intern Med. 2005; 19(5):725-731.
- McConnell JF, Garosi L, Platt SR. Magnetic resonance imaging findings of presumed cerebellar cerebrovascular accident in twelve dogs. Vet Radiol Ultrasound. 2005;46(1):1-10.
- Gonçalves R, Carrera I, Garosi L, Smith PM, Fraser McConnell J, Penderis J. Clinical and topographic magnetic resonance imaging characteristics of suspected thalamic infarcts in 16 dogs. Vet J. 2011; 188(1):39-43.
- Rossmeisl JH Jr, Roehleder JJ, Picket JP, Duncan R, Herring IP. Presumed and confirmed striatocapsular brain infarctions in six dogs. Vet Ophthalmol. 2007; 10(1):23-36.
- Hoggard N, Wilkinson ID, Paley MN, Griffiths PD. Imaging of haemorrhagic stroke. Clin Radiol. 2002:57(11):957-968.
- Weingarten K, Zimmerman RD, Deo-Narine V, Markisz J, Cahill PT, Deck MD. MR imaging of acute intracranial hemorrhage: findings on sequential spin-echo and gradient echo images in a dog model. AJNR Am J Neuroradiol. 1991; 12(3):457-467.
- Schwab S. Therapy of severe ischemic stroke: breaking the conventional thinking. Cerebrovasc Dis. 2005; 20(Suppl 2):169-178.
- Syring RS, Otto CM, Drobatz KJ. Hyperglycemia in dogs and cats with head trauma: 122 cases (1997–1999). J Am Vet Med Assoc. 2011;218(7):1124-1129.
- Hickenbottom SL, Grotta J. Neuroprotective therapy. Semin Neurol. 1998; 18(4):485-492.
- Ovbiagele B, Kidwell CS, Starkman S, Saver JL. Neuroprotective agents for the treatment of acute ischaemic stroke. Curr Neurol Neurosci Rep. 2003; 3(1):9-20.
- De Reuck J, Vandekerckhove T, Bosma G, et al. Steroid treatment in acute ischaemic stroke. A comparative retrospective study of 556 cases. Eur Neurol. 1988; 28(2):70-72.
- Labiche LA, Grotta JC. Clinical trials for cytoprotection in stroke. NeuroRx. 2004; 1(1):46-70.
- Van Kooten F, Ciabattoni G, Patrono C, Dippel DW, Koudstaal PJ. Platelet activation and lipid peroxidation in patients with acute ischemic stroke. Stroke. 1997; 28(8):1557-1563.
- NINDS t-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. N Engl J Med. 1995; 333(24):1581-1587.
- NINDS t-PA Stroke Study Group. Intracerebral haemorrhage after intravenous t-Pa therapy for ischemic stroke. Stroke. 1997; 28(11):2109-2118.
- NINDS t-PA Stroke Study Group. Generalized efficacy of t-PA for acute stroke. Subgroup analysis of the NINDS t-PA Stroke Trial. Stroke. 1997; 28(11):2119-2125.
- Joseph RJ, Greenlee MS, Carrillo JM, Kay WJ. Canine cerebrovascular disease: clinical and pathological findings in 17 cases. J Am Anim Hosp Assoc. 1988; 24(5):569-576.
- Subramaniam S, Hill MD. Controversies in medical management of intracerebral hemorrhage. Can J Neurol Sci. 2005; 32(Suppl 2):S13-S21.












